Мар’ян Васильович Гребеник, д.мед.н., професор, завідувач кафедри терапії та сімейної медицини Факультету післядипломної освіти Тернопільського національного медичного університету імені І.Я. Горбачевського
МОЗ України
Використання антиаритмічних препаратів (ААП) ІС класу в пацієнтів зі стабільною ІХС, або хронічним оронарним синдромом згідно з рекомендаціями Європейського товариства кардіологів (ESC, 2019, 2024), було історично
обмежене через побоювання щодо їх проаритмічних ефектів (за даними досліджень CAST 1989 р. і CAST-І 1991 р.). Особливо це стосувалося осіб з ішемією міокарда або структурним захворюванням серця. ААП IC класу залишаються протипоказаними хворим на ІХС групи високого ризику в сучасних гайдлайнах, як-то рекомендації ESC (2020, 2024) щодо менеджменту пацієнтів із ФП, настанова ESC (2022) щодо ведення пацієнтів із шлуночковими аритміями та профілактики раптової серцевої смерті, а також рекомендації Американської колегії кардіологів і Американської асоціації серця (ACC/AHA, 2023). Проте нові дані свідчать про те, що ці препарати можна обережно застосовувати у належним чином відібраних пацієнтів з ІХС та мінімальними структурними змінами у серці. Розглянемо успішне застосування ААП ІС класу, зокрема етацизину, в пацієнтів з ІХС на прикладі клінічних випадків.
Клінічний випадок
Пацієнт Б. віком 77 років, перебуває під спостереженням з 2004 р. із приводу АГ, у цей же період зафіксовано безсимптомну рідку суправентрикулярну екстрасистолію (СВЕ).
Попереднє лікування. Для контролю артеріального тиску (АТ) тривало приймав β-блокатор (бісопролол у дозі 5 мг/добу) та антагоніст кальцієвих каналів (лерканідипін по 10 мг/добу, який потім через недостатню ефективність було замінено на лацидипін у дозі 4 мг/добу). Із лютого 2005 р. терапію посилено діуретиком (індапамідом по 2,5 мг/добу). На тлі оптимального медикаментозного контролю АТ (~130/80 мм рт. ст.) з’явилися відчуття періодичної аритмії, яка мала транзиторний перебіг. До терапії було додано триметазидин у пролонгованій формі (35 мг двічі на добу). У січні 2006 р. клінічно зафіксований епізод транзиторної групової екстрасистолії на тлі тривалого емоційного перевантаження, розвинувся кардіалгічний синдром, який не вкладався у симптоматику ангінозного статусу.
Додаткове обстеження. Ліпідограма, ехокардіоскопія не виявили суттєвих відхилень. При одночасному проведенні добового моніторування АТ і електрокардіограми (ДМЕКГ) було встановлено відносний контроль АГ («межова гіпертензія»), зафіксовано до 200 екстрасистол СВЕ та два епізоди безбольової ішемії (один із них співпав із болем голови та підвищенням АТ). Тест на велоергометрі підтвердив наявність прихованої коронарної недостатності (І функціонального класу [ФК]; 150 Вт).
Корекція терапії. Із 2014 р. у пацієнта реєструються пароксизми ФП (ПФП), які успішно вдається контролювати застосуванням 50‑100 мг етацизину. Чоловік постійно приймає лише β-блокатор (небіволол у дозі 5 мг/добу) та призначені раніше антигіпертензивні препарати, етацизин – на вимогу, за принципом «таблетка в кишені». З 2017 р. через почастішання ПФП і оцінку за шкалою CHA2 DS2 VASc 2 бали до лікування додано ривароксабан у дозі 20 мг, а для стабілізації ритму пацієнт перейшов на постійне використання етацизину по 50 мг двічі на добу.
Впродовж наступних років частота ПФП знизилася, навіть під час COVID‑19 не було суттєвого загострення аритмічного синдрому.
У 2023‑2024 рр. під час неодноразових амбулаторних візитів та проведення динамічного ДМЕКГ ПФП не зафіксовано. Таким чином, пацієнт стабільно отримував етацизин протягом останніх дев’яти років без будь-яких побічних ефектів.
Висновок. Слід відзначити високу прихильність хворого до терапії, а також педантичність та акуратне ведення щоденників стану здоров’я, проведених досліджень і лікувальних режимів. Динаміка ліпідограми, даних ехокардіоскопії залишалася оптимальною: рівень холестерину (ХС) ліпопротеїнів низької щільності (ЛПНЩ) – у межах 2,25‑1,32‑1,62‑1,54 ммоль/л, площа лівого передсердя і фракція викиду (ФВ) лівого шлуночка (ЛШ) – 17‑19‑18‑19 см2 та 65‑65‑65‑63% у 2016‑2019‑2023‑2025 р. відповідно.
Клінічний випадок
Пацієнт П. віком 78 років, має верифіковану ІХС (2016 р. переніс коронарне втручання з імплантацією чотирьох непокритих стентів), тривалий анамнез АГ, метаболічні порушення у вигляді ожиріння І ст. (індекс маси тіла [ІМТ] – 32 кг/м2) та дисліпідемії. Упродовж тривалого періоду спостереження домінуючою скаргою, яка суттєво впливала на якість життя, була екстрасистолія.
Анамнез. Вперше порушення ритму були зареєстровані у 1982 р. на тлі постдифтерійного міокардиту, які виявилися рефрактерними до аміодарону. Однак суттєве погіршення самопочуття, а саме почастішання екстрасистолії, які потребували втручання, зафіксовані у 1996 р. після надмірного емоційного стресу і появи АГ.
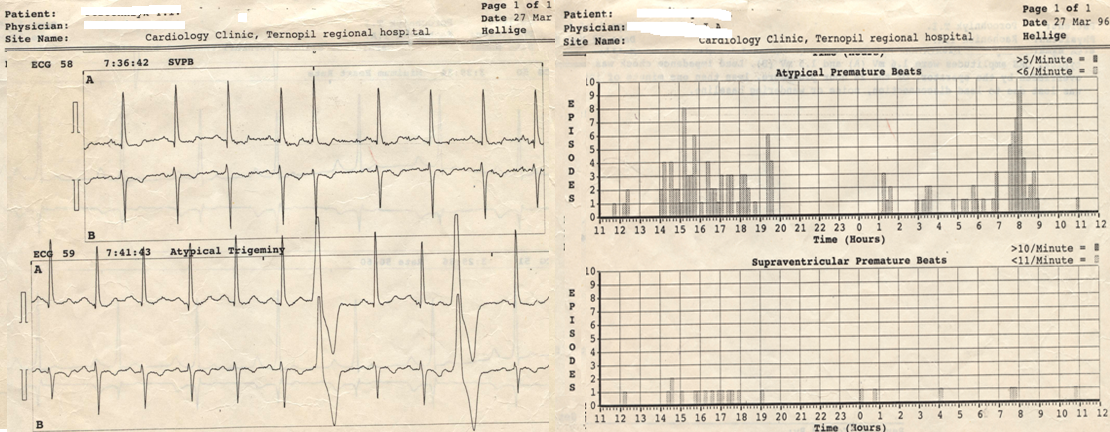
Терапія. Лікування із застосуванням β-блокаторів та інших антигіпертензивних засобів дозволило стабілізувати АТ, однак було недостатнім щодо контролю порушення ритму. Тоді вперше пацієнтові було призначено етацизин, який виявився досить ефективним. Проведене ДМЕКГ (27.05.1996) – фонове та після використання
одноразової дози етацизину 50 мг – підтвердило повне усунення екстрасистолії на період до 6 год (рис. 1). Із того часу чоловік тривало приймав етацизин по 100‑150 мг/добу. Спроби перерв у використанні препарату супроводжувалися відновленням частої екстрасистолії, яка при ДМЕКГ могла сягати 12,5% за 24 год.
Подальше спостереження. Особливістю порушення риму була схильність до алоритмії, окремі ектопічні комплекси мали різну направленість, періодично були різнофокусні, а іноді – спарені; загалом домінувала шлуночкова екстрасистолія (ШЕ) порівняно із надшлуночковою. Згідно з даними чисельних досліджень добового ритму, фіксувалися екстрасистолії класу 3‑4 за класифікацією Lown, при цьому середньодобова частота
серцевих скорочень (ЧСС) становила ~60 уд./хв.
Щойно пацієнт продовжував систематично приймати етацизин, добова частота екстрасистол становила менш ніж 1%.
Прогресування ІХС, проведене стентування, зменшення ішемічних епізодів загалом не впливали на перебіг екстрасистолії за умови лікування етацизином (при спробі відміни, у зв’язку із клінічною симптоматикою ІХС, добова кількість екстрасистол збільшувалася до 24%).
На тлі стабільного перебігу ІХС, медикаментозно контрольованої АГ та задовільних показників ехокардіоскопії (гіпертрофія стінок – до 1,25 см, ФВ ЛШ – 51%) супутня терапія етацизином не супроводжувалася жодними побічними ефектами. Неодноразові спроби обмежити застосування етацизину через ІХС викликали супротив
пацієнта («з етацизином мені спокійніше»).
Із 2023 р. у пацієнта реєструвалися ПФП, які ефективно контролювалися додатковою дозою етацизину. Зважаючи на прогресування аритмічного синдрому у вигляді ФП, деяке зниження ФВ ЛШ у динаміці, появу частотозалежної транзиторної блокади правої ніжки пучка Гіса, чоловікові було настійно рекомендовано відмовитися від подальшого використання етацизину.
Однак у 2024 р. він двічі був госпіталізований із приводу ПФП. В обох випадках пацієнт самостійно вдома приймав етацизин за принципом «таблетка в кишені». Під час госпіталізації в обох випадках відбулася конверсія ритму в синусний без додаткового втручання. Слід зазначити, що перед відновленням ритму на ЕКГ
було зафіксовано тахіаритмію із широкими комплексами QRS. Тому чоловікові було ще раз наголошено про ймовірну небезпеку вживання етацизину і протипоказання щодо його наступного застосування, зважаючи на зміни у клінічному статусі.
Висновок. Загалом тривале, практично 30-річне використання етацизину було ефективним і безпечним, попри зміни перебігу коморбідної патології.
Як відомо, поступове прогресування ІХС і зниження ФВ ЛШ створюють передумови для перегляду антиаритмічної терапії. Водночас залишається багато дискусійних питань щодо оптимальної тактики, зокрема при лікуванні ФП у пацієнтів із різними проявами ІХС.
Підсумки